
;
。
①若将8tCH4用于制取H2 , 假设每一步均完全反应,理论上可制得H2t。
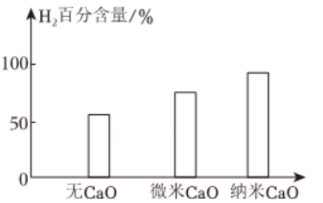
②如图所示,向CH4-H2O催化重整体系中投入定量的CaO可提高H2百分含量,而投入纳米CaO时H2的百分含量最大,原因可能是。
A.LaNi5H6 B.LiAlH4 C.Mg2FeH6 D.Al(BH4)3
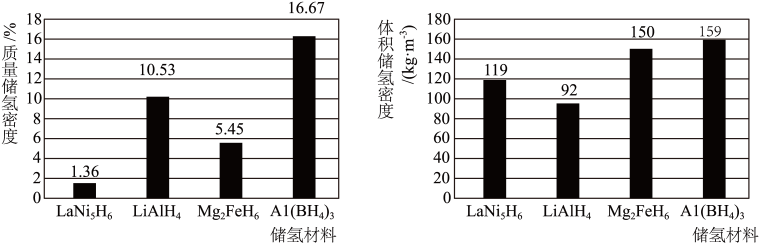
(已知:质量储氢密度=储氢后氢元素在储氢材料中的质量分数,体积储氢密度=储氢后单位体积的储氢材料中储存氢元素的质量)
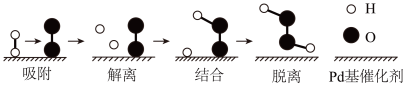
“解离”时,结构被破坏的分子是(填化学式)。该反应的化学方程式为。
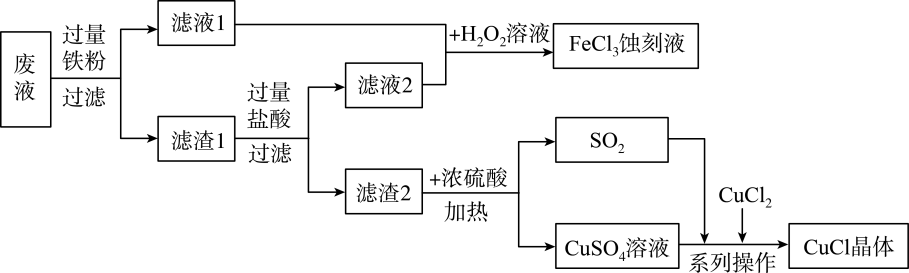
【查阅资料】①CuCl是一种白色晶体,不溶于乙醇而溶于氨水,在空气中迅速氧化,变成绿色,见光分解,变成褐色;
②
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
【查阅资料】
1.抗酸药主要利用有效成分与胃液中的过量盐酸反应,药品用量一般为1~2片(约0.5g~1g)
2.氧化镁和氧化铁均属于金属氧化物,与盐酸反应的原理相似。
3.胃蛋白酶是胃中唯一的消化性蛋白酶,当pH为3~5时活性较好,当pH超过6时,因变性而失去活性。
4.理想抗酸药应具备起效快速,避免产生气体刺激溃疡面等特点。
【进行实验】
I.是否引起胃内压强的变化
锥形瓶中模拟胃酸过多的环境。将气球中的抗酸药加入锥形瓶中。
装置及药品 | 序号 | 抗酸药 | 现象 |
| 1-1 | 氢氧化铝片 | 气球无明显变化 |
1-2 | 碳酸氢钠片 | 气球明显膨胀 | |
1-3 | 铝碳酸镁咀嚼片 | 气球无明显变化 | |
1-4 | 氧化镁粉末 | 气球无明显变化 |
Ⅱ.是否引起胃内温度和pH的变化
利用图1进行实验。向4个烧瓶中分别加入抗酸药,打开恒压滴液漏斗,滴加0.37%的足量稀盐酸。传感器测得的相关结果见图2、3、4。
|
|
|
|
【解释与结论】
查阅资料发现Ⅰ中实验1-3无明显现象是与物质的用量有关。小明同学设计实验证明了铝碳酸镁咀嚼片中含有碳酸根离子,实验操作和现象:取6片铝碳酸镁咀嚼片于试管中,。