红烧狮子头 水煮鱼片 炒青菜、海带汤 米饭、桔子 |
①合理膳食可增强体质。下列说法错误的是。
A.鱼片含有丰富蛋白质
B.淀粉可分解为氨基酸
C.适度补充油脂,有益身体健康
②若需补充维生素C,建议多吃食谱中(写出一种即可)。
③食用加碘盐可补充碘元素。下列说法正确的是。
A.人体中缺少碘元素,会导致骨质疏松
B.除加碘盐外,还可以通过食用海带等海产品补充碘元素
C.加碘盐中添加了碘酸钾(KIO3),淀粉可用于检验其中碘元素的存在
④学校正推行垃圾分类。餐后的食物残渣应投入印有标识的垃圾箱。


①下列做法不属于低碳生活方式的是。
A.随手关灯
B.旧书本循环利用
C.夏天将空调温度调至最低
②下列做法不利于自行车防锈的是。
A.金属部件镀金属铬
B.链条涂防锈油
C.雨淋后自然晾干
③铁锈成分中含有氧化铁(Fe2O3),写出氧化铁与稀硫酸反应的化学方程式。
④某学生做了铁的锈蚀实验,装置如图。一段时间后可观察到导管内红墨水的液面(填“上升”或“下降”)。

①土壤酸化不利于农作物生长。要改良酸化土壤,可选用的物质为。
A.KNO3 B.熟石灰 C.稀硫酸
②某农田改良后pH为5.4,该地区常见农作物最适宜生长的土壤pH范围如下:
农作物 | 茶树 | 油菜 | 水稻 | 萝卜 |
pH | 5.0-5.5 | 5.8-6.7 | 6.0-7.0 | 7.0-7.5 |
该农田适合种植的农作物是。
③化肥和农药对农业增产有重要作用。下列说法错误的是。
A.铵态氮肥不能与草木灰混用
B.磷酸二氢铵(NH4H2PO4)属于复合肥料
C.为增加农作物产量,大量使用化肥和农药
④碳酸氢铵(NH4HCO3)需密封保存于阴凉处,用化学方程式解释原因。
我国科学家利用CO2合成葡萄糖,该方案先用碳电还原法将CO2转化为醋酸,再利用微生物发酵获得葡萄糖。

①将CO2资源化利用,可减少效应。
②通电条件下,装置1中CO2分解成CO和常见单质X,X的化学式为。
③利用酵母菌等微生物将醋酸转化为葡萄糖时,温度不宜过高,原因是。
④理论上合成葡萄糖所需CO2与H2O的质量比为。
②分离出的浓盐水是(填“纯净物”或“混合物”)。
③该方法除了用于海水淡化,还可用于。
A.硬水软化 B.污水处理 C.物质鉴别
国家规定居民生活用水中盐类物质总含量≤500mg·L-1 , 计算并推断所得淡水中盐类总含量生活用水的标准(填“达到”或“未达到”);该工厂一套淡化装置每小时产生浓盐水300L,其中含有NaClkg。
| 氯化钠 | 氯化镁 | 硫酸镁 | 硫酸钙 |
淡水 | 0.17 | 0.012 | 4.8×10-4 | 8.5×10-4 |
浓盐水 | 45.0 | 3.6 | 3.3 | 0.14 |

①写出生成Mg(OH)2的反应方程式。
②浓盐水经过步骤1和2两步反应后又获得了MgCl2 , 设计这两步的目的是。
③图中未涉及的反应类型为。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
④镁在空气中燃烧发出耀眼白光,依据此现象可用镁制作(写出一种即可)。

①用图中仪器完成实验,还缺少的玻璃仪器是(填名称),玻璃棒在配制实验中的作用是。
②配制该溶液需要g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数10%。(填“大于”或“小于”)
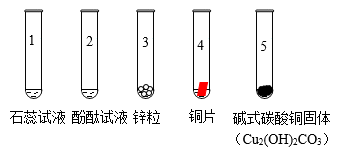
①中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn(填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为。
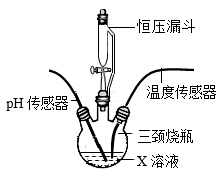
①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是,实验进行到60s时溶液中的溶质为(填化学式)。

②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中能量的结论(填“吸收”或“释放”)。
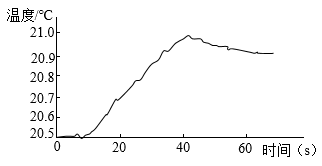
③丙同学提出,通过监测三颈烧瓶内压强变化,也可以推导出乙同学的实验结论,其理由是。
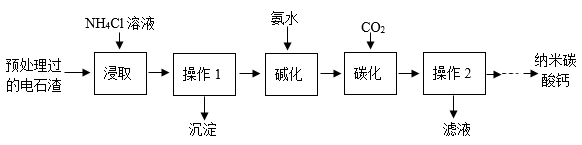
已知:①NH4Cl溶液显酸性;
②“浸取”时的主要反应为;
③“碳化”时的主要反应为。


温度 | 反应液浑浊所需时间(单位:秒) | 反应完全所需时间(单位:分钟) |
20℃ | 480 | >180 |
40℃ | 120 | 180 |
60℃ | 1 | 50 |
80℃ | 1 | 68 |
实际碳化反应的温度采用了60℃,温度不宜过高的原因可能是(写出一条即可)。